Характеристики объектива являются первостепенными в определении пространственной разрешающей способности и количества света, достигающего светочувствительных элементов. В общем, объективы характеризуются тремя основными параметрами: числовой апертурой, увеличением и степенью оптической коррекции. Вопреки расхожему мнению, увеличение является наименее важным параметром. Увеличение определяет лишь, насколько большим покажется объект в окуляре или фотоприёмнике, но не влияет на разрешающую способность (размер наименьшей различимой детали) или яркость (количество собираемого флуоресцентного сигнала) изображения.
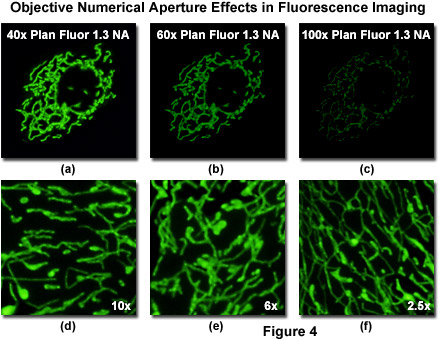
Рис. 4. Влияние числовой апертуры объектива на формирование флуоресцентных изображений
Для подробного ознакомления с медицинской и исследовательской техникой основных мировых производителей оптических систем и сопутствующего оборудования посетите наш каталог или свяжитесь с нашими специалистами и получите полную профессиональную консультацию по любым, имеющимся у Вас, вопросам.
Разрешающая способность и яркость определяются числовой апертурой, которая является наиболее важным критерием при выборе объектива. Числовая апертура определяет количество света, проходящего через переднюю линзу, поэтому для количественного анализа изображений флуоресцентных белков следует выбирать максимально возможную числовую апертуру. Общий принцип формирования любого изображения прост: при возрастании отношения сигнал-шум, растёт и качество изображения. Этот принцип особенно критичен при формировании изображения в лазерной сканирующей конфокальной микроскопии, где число собираемых фотонов весьма мало (обычно всего несколько фотонов на пиксель). Поэтому тщательный выбор объектива особенно необходим при оптимизации способа собирания фотонов. Заметим, что полная яркость изображения пропорциональна четвёртой степени числовой апертурой объектива, делённой на квадрат увеличения.
Важность числовой апертуры, как основного параметра, определяющего разрешающую способность и яркость изображения, показана на рисунке 4. В качестве образца взята культура адгезивных клеток остеосаркомы человека (U2OS линия), трансфектированных плазмидным вектором, кодирующим усиленный зелёный флуоресцентный белок, слитый с митохондриально направленной нуклеотидной последовательностью из субъединицы VIII цитохром-с-оксидазы человека. При транскрипции и трансляции в трансфектированных клетках-хозяинах млекопитающего, по сигналу, поступающему от митохондрий можно определить перенос и распределение химерных флуоресцентных белков по митохондриальной сети клетки. Впоследствии, методами флуоресцентной микроскопии можно визуализировать митохондриальные трубочки.
На рисунке 4 представлены результаты наблюдения одного и того же поля зрения объективами с одинаковой оптической коррекцией (plan fluorite) и числовой апертурой (1,3), но разным увеличением (от 40х до 100х).
Хотя изображения на рисунке 4 формировались одним и тем же числом пикселей и при одинаковых настройках фотоприёмника, наиболее ярким изображение митохондрий получилось при использовании объектива кратностью 40х (рисунок 4(а)). И напротив, объективы большего увеличения (60х — рисунок 4(b) и 100х — рисунок 4(с)) создавали всё более тёмное изображение (при увеличении 100х оно почти неразличимо). Последний объектив всё же можно использовать для наблюдения образца, но необходимо существенно увеличить усиление фотоприёмника, а это приведёт к ухудшению отношения сигнал-шум и снижению качества снимка. Следует заметить, что значения разрешающей способности объективов (рисунок 4(d) — (f)) сравнимы из-за одинаковых значений числовой апертуры.
Одним из основных выводов, которые следует сделать из снимков на рисунке 4, является необходимость избегать чрезмерного увеличения при выборе объектива для наблюдения флуоресцентных белков (и, собственно говоря, других флуророфоров). Простым цифровым увеличением (трансфокацией) при формировании изображения на конфокальном микроскопе с объективом 40х можно получить снимок, эквивалентный по масштабу тому, который был получен с помощью объектива 100х (рисунок 4(d) (f)). Разрешающая способность обоих объективов одинакова, поскольку равны их числовые апертуры. Тем не менее, не следует думать, что применение объективов 60х и 100х вообще не имеет никаких преимуществ. На самом деле, объективы с высокой кратностью увеличения часто необходимы при наблюдении широкопольными микроскопами очень малых объектов, таких как пероксисомы или секреторные гранулы. Поскольку от отношения размера изображения к размеру фотоприёмника зависит частота пространственной дискретизации, оптимальное увеличение определяется параметрами цифровой камеры (размером пикселя ПЗС и промежуточной кратностью увеличения). Таким образом, выбор объектива зависит не только от специфических требований отдельного эксперимента, но и от оптической конфигурации измерительного прибора.
Высоко скорректированные объективы (апохроматы) необходимо применять с осторожностью, и если можно обойтись без них, лучше их не использовать. Повышение оптической коррекции (например, от флюоритового объектива к апохромату) хроматической аберрации и плоскостности поля требует установки дополнительных линз. Каждая дополнительная линза ведёт к общему падению пропускания света через объектив, то есть к уменьшению сигнала, достигающего фотоприёмника. Хотя высоко скорректированные линзы необходимы для отдельных приложений, таких как мультиокрашенная визуализация, при их использовании сложнее добиться высокого отношения сигнал-шум (а значит и высокого качества изображения), особенно при наблюдении димерных флуоресцентных белков, таких как HcКрасный или ECFP. Суммируя вышесказанное, можно заключить, что флюоритовый объектив 40х (числовая апертура 1,3) предпочтительнее для наблюдения образцов, окрашенных одним флуоресцентным белком, но в экспериментах с мультиокрашенными образцами (два или более флуоресцентных белка) необходим апохроматический объектив, обеспечивающий коррекцию цвета.
Формирование многоцветных изображений флуоресцентными белками
Главной причиной появления многоцветной палитры флуоресцентных белков является стремление одновременно отслеживать сразу несколько происходящих в клетке явлений. Учитывая постоянно растущее число вариантов флуоресцентных белков (см. таблицу 1), следует заметить, что процесс их комбинирования уже не столь очевиден. При планировании экспериментов по наблюдению живых клеток с применением двух или более красителей одновременно, необходимо учитывать ширину спектральных профилей возбуждения и испускания, демонстрируемых флуоресцентными белками и их смещёнными по цвету генетическими вариантами. Особое внимание необходимо уделять возможным артефактам, связанным с проступанием (то есть «перетеканием» флуоресценции из канала одного красителя в канал другого), что является следствием значительного перекрывания спектров при комбинировании флуоресцентных белков.
Проступание (часто называемое захлёстыванием или перетеканием) может возникнуть как при возбуждении различных флуоресцентных белков, так и при их свечении. При исследовании свойств флуоресцентных красителей оказалось, что проступание возникает ближе к синему концу спектра (короткие волны), в то время как артефакты наиболее резко выражены в красном конце (длинные волны) при испускании. Например, зелёный флуоресцентный белок часто можно обнаружить через красные эмиссионные фильтры, но красный флуоресцентный белок через зелёные фильтры обычно не виден. По этой причине, при формировании многоцветных изображений флуоресцентных белков в первую очередь необходимо визуализировать зонды с наибольшей длиной волны испускания, возбуждая их на длинах волн, не «заезжающих» на спектры коротковолновых красителей. Например, при наблюдении EYFP и EGFP в одной и той же клетке с применением аргонового ионного лазера, первым должен собираться сигнал от возбуждения EYFP на линии 514 нанометров, лежащей вне профиля поглощения EGFP, с помощью эмиссионного фильтра с полосой пропускания 530–550 нанометров. Ширина полосы эмиссионного фильтра не особенно критична, если возбуждается только EYFP. Во втором цикле сканирования наблюдается EGFP. Он возбуждается на 477-нанометровой линии аргонового ионного лазера и высвечивает через эмиссионный фильтр с очень узкой полосой между 490 и 500 нанометрами. Этот фильтр должен быть правильно расположен, чтобы исключить флуоресценцию от EYFP и, в то же время, уловить сигналы от EGFP (довольно утомительное занятие). Хотя 488-нанометровый пик аргонового ионного лазера лежит ближе к максимуму возбуждения EGFP, он всё же слишком близок к полосе пропускания эмиссионного фильтра, что не исключает возможности интерференции отражённого лазерного луча и флуоресцентных сигналов.
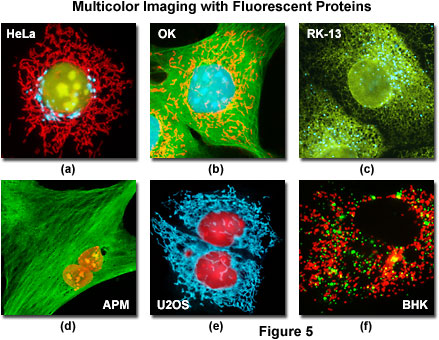
Рис. 5. Формирование многоцветных изображений флуоресцентными белками
При формировании многоцветных изображений с применением двух или более флуоресцентных белков необходимо уделять должное внимание контролю проступания флуоресценции с помощью продуманного подбора фильтров. Следует, однако, заметить, что существенное урезание полосы пропускания фильтра возможно лишь за счёт отношения сигнал-шум (поскольку её шириной, в частности, и определяется количество собираемого сигнала) и временно?го разрешения, связанного с необходимым разделением приёма сигналов во времени. Необходимо также иметь в виду, что для оптимальных условий визуализации часто могут потребоваться специальные оптические конфигурации для каждого отдельного эксперимента. Например, для визуализации вариантов зелёных флуоресцентных белков в присутствии жёлтых дериватов необходимы комбинации фильтров, довольно специальные для стандартных конфокальных микроскопов. Поскольку количество флуоресцентных белков с различными спектральными профилями продолжает расти, будет расти и необходимость в специфических комбинациях фильтров.
На рисунке 5 представлена серия снимков клеточных линий, одновременно трансфектированных двумя или более флуоресцентными белками, слитыми с субклеточными мишенями. Клетки HeLa, представленные на рисунке 5(а), были окрашены зондами EYFP (ядро), ECFP (Гольджи) и DsRed2FP (митохондрии). Все три зонда чётко разделены широкопольными комбинациями флуоресцентных фильтров компании Nikon (CFP, YFP, HYQ и CY3 HYQ).
Эпителиальные клетки почки опоссума (OK линия), трансфектированные белками EGFP (тубулин), ECFP (ядро) и DsRed2FP (митохондрии) и наблюдаемые с помощью стандартных комбинаций фильтров, представлены на рисунке 5(b). Аналогично, на рисунке 5(с) представлены клетки почки кролика (RK-13 линия), трансфектированные белками EYFP (эндоплазматическая сеть) и ECFP (пероксисомы) и визуализированные с применением фильтрационных блоков CFP и YFP HYQ компании Nikon. Клетки африканского водяного мангуста (APM), представленные на рисунке 5(d), были трансфектированы белками EGFP (тубулин) и DsRed2FP (ядро), а клетки остеосаркомы человека (U2OS линия; рисунок 5(е)) были окрашены тем же красителем ядра наряду с белком ECFP (митохондрии). И, наконец, клетки почки детёныша хомяка (клеточная линия BHK), представленные на рисунке 5(f), были трансфектированы белками EGFP (пероксисомы) и DsRed2FP (митохондрии). Все снимки, представленные на рисунке 5, были получены широкопольным флуоресцентным микроскопом в сочетании с комбинациями фильтров Nikon, оптимизированными для соответствующих флуоресцентных белков.
Хотя самыми яркими флуоресцентными белками являются зелёные и жёлтые белки (см. таблицу 1), их спектральные максимумы разделены всего 20–25 нанометрами. Эксперименты по мультиокрашиванию комбинированием зелёных и жёлтых флуоресцентных белков возможны, но при этом серьёзной проблемой становится проступание между комбинациями фильтров Как следствие, зелёные и жёлтые белки обычно не используются вместе. Одной из наиболее популярных пар красителей является комбинация голубого и жёлтого флуоресцентного белка (ECFP и EYFP, см. рисунок 5). Хотя ECFP не намного ярче EBFP, у него есть два преимущества: он эффективно возбуждается на 457-нанометровой линии аргонового ионного лазера и не так быстро фото обесцвечивается (как показано на рисунке 2).
Объединение дериватов DsКрасного с зелёными или жёлтыми флуоресцентными белками является хорошей комбинацией, поскольку спектры испускания этих красителей легко разделяются. Тем не менее, к выбору вариантов DsКрасного необходимо относиться с должным вниманием из-за их разных сроков созревания. Более того, поскольку DsКрасный и его дериваты образуют облигатные тетрамеры in vivo, их применение может быть причиной нежелательных воздействий на биологию белковых систем (скопление и локализация вокруг органелл, не исследуемых в данном эксперименте). К сожалению, не существует достоверного эмпирического правила для предсказания эффективности дериватов DsКрасного в качестве гибридных меток, к тому же, некоторые белки переносят олигомеризацию, а другие нет. Для тройного окрашивания с применением только флуоресцентных белков (рисунок 5(а) и 5(b)) комбинация голубого, жёлтого (или зелёного) и DsКрасного является превосходным решением.
При формировании изображений живых клеток двумя или более флуоресцентными белками неизбежно приходится идти на определённые компромиссы. Например, скорость сбора информации падает каждый раз при добавлении цвета, поскольку каждый краситель требует своих условий формирования изображения. Всё труднее становится контролировать проступание флуоресценции, особенно потому, что спектральные профили флуоресцентных белков имеют тенденцию к уширению (а часто и перекрыванию). К тому же, поскольку популярные флуоресцентные белки отличаются относительной яркостью (таблица 1), для каждого цвета может требоваться своё время интегрирования сигналов. Голубые и синие флуоресцентные белки довольно тусклые и могут требовать больше времени для собирания идущих от них сигналов, что ведёт к насыщению более ярких зелёных и жёлтых флуоресцентных белков. Поэтому при выборе флуоресцентных белков важно найти баланс между параметрами эксперимента (по сути, между скоростью формирования изображения и оптимальным разделением цветов). Например, для быстрого и эффективного формирования изображения хорошим выбором является комбинация EYFP и DsКрасного, поскольку для этих флуоресцентных белков можно использовать одинаковые настройки возбуждения, в то время как применение ECFP и EYFP может обеспечить высокую степень спектрального разделения.
Заключение
Совокупность доступных сегодня флуоресцентных белков и средств визуализации позволяет специалисту клеточной биологии эффективно отслеживать динамику белков в живых клетках и достигать новых уровней изучения поведения белков, органелл и самих клеток. Эти замечательные красители открыли новую эру в клеточной биологии, где с применением стационарных и кинетических микроскопических методов расшифровываются сложные биологические процессы. Благодаря быстрому развитию микроскопических систем для наблюдения живых клеток, включая основанные на эмиссии вторичных электронов ПЗС камеры, работающие в условиях низкой освещённости, конфокальные приборы с вращающимися дисками и сканирующие микроскопы со щелевой диафрагмой, стало возможным наблюдение флуоресцентных белков и оптических маркеров во всём видимом и ближнем инфракрасном диапазоне практически в реальном времени.